
|
|
|
STRUCTURA DE BAZA A POMPEI DE EFLUX CU ROL IN REZISTENTA LA MEDICAMENTE, EmrE , PREZENT LA Escherichia coli
Transportorii implicati in rezistenta la medicamente, ce asigura efluxul acestora, sunt folositi in tratarea bolilor infectioase, cu rolul de expulzare in mediul extracelular al componentelor citotoxice si a medicamentelor.
Un astfel de transportor este si EmrE, din familia transportorilor de mici dimensiuni, componenti ai acestei familii fiind specializati in rezistenta la medicamente, utilizand gradienti de protoni ca sursa de energie pentru conducerea translocatiei la nivel de substrat.
La o rezolutie de 3.8Ǻ, EmrE, este un tetramer ce conține 2 heterodimeri conformaționali, legați printr-o axa perpendiculara imaginara, de simetrie, la membrana celulara.
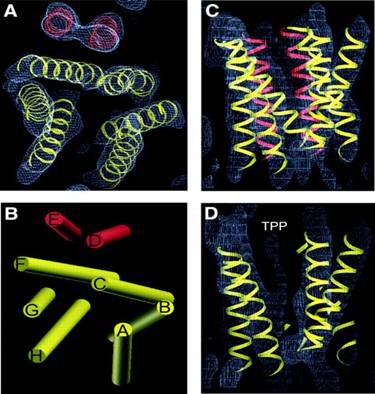
Fig.19. Structura 3D a pompei de eflux
EmrE. A. vedere de sus perpendiculara pe planul membranei. B.
Arhitectura in cilindru a helicelor din plan perpendicular pe planul
membranei. C. vedere in lungul membranei la o densitate de 1.2Ǻ. D.
vedere din lateral in plan membranar. Cele 2 seturi de grupari de
helice, unul galben- buzunarul de legare la substrat, și al doilea,
roșu, separat de buzunarul de legare. / http://www.nature.com/emboj/journal/v22/n23/fig_tab/7595521f2.html
Pe baza dovezilor structurale și biochimice, este propus un mecanism prin care EmrE realizeaza efluxul medicamentelor prin cuplarea schimbarilor conformaționale intre cei 2 heterodimeri cu gradient de protoni.
Structura este chiar simpla și compacta, de aceea poate servi ca model ideal in intelegerea structurii tipice a unui antiportor proton - medicament, pentru alte sisteme de eflux al medicamentelor.
Superexpresivitatea EmrE, cauzeaza bacteriei E.coli, o rezistenta sporita la contactul cu componente cationice, toxice și hidrofobe de gen bromura de ethidium, metil- viologen, tetraciclina și tetrafenilfofonium, la antiseptice.
EmrE este un antiportor de proton - medicament, dirijand indreptarea gradienților protonici electrochimici, in direcția opusa, avand in jur de 60 de omologi atat la bacterii Gram - pozitive cat și Gram - negative.
Fiind cel mai mic transportor, EmrE, de la E.coli este o molecula mica de 12 kDa, avand 110 resturi de aminoacizi și 4 helice. Este o proteina hidrofoba, cu doar 8 resturi incarcate cu sarcini, incluzand Glu - 8, necesar in activitatea de eflux al medicamentelor.
In urma cristalografierii cu raze X, structura EmrE dezvaluie un tetramer compus din 2 heterodimeri conformaționali legați printr-o axa lunga perpendiculara de simetrie, la suprafața membranei.
Intr-un heterodimer, helicele α1, α2, α3, ale unei subunitați sunt aranjate aproape invers fața de cele ale celuilalt monomer, formand o impachetare de 6 helice cu miez hidrofob.
Poziția helicei α4 aparținand unei subunitați este aproape paralela cu suprafața membranei, iar o alta parte patrunde in planul membranei. Aceasta poziționare a α4 pe lateral, de-a lungul suprafeței membranare, a fost observat și la nivelul altor membranei altor proteine, cum ar fi E si M de la flavivirusuri.
Cea mai interesanta parte a structurii, este reprezentata de orientarea inversata a polipeptidelor ce intra in alcatuirea conformației heterodimerilor.
Deși un fapt inca nedovedid, aranjamentul conformațional este datorat unor posibile fuzionarii de gene, evenimente ce dau și alți transportori, de exemplu exportori de medicamente - metaboliți din cadrul acestei familii de transportori, ale caror subunitați omoloage se crede ca s-ar inversa la nivelul substratului.
Aceasta fuziune este susținuta de structuri precum canalele de clor, aquaporine și vitamina transportata de BtuCD din familia transportorilor ABC-MDR, ce prezinta subdomenii transmembranare inversate, codificate de o singura polipeptida.
In cazul EmrE, exista un potențial ce unește capatul C-terminal al α4, aparținand unui monomer, cu capatul N-terminal a helicei α4, aparținand celuilalt monomer, intr-un dimer asimetric.
Acest lucru poate explica cum subunitațile transmembranare sunt formate la transportorii evoluați.
Tetramerul este alcatuit din contacte ale α1 de la ambii heterodimeri, formand un unghi de 90̊.
Aria ingropata este de aprox. 550Ǻ, conține molecula relativ mica a EmrE, și poate reflecta starea conformației prinsa de forma acestui cristal.
La acest nivel, o grupare de Glu14s de importanța funcționala și o serie de resturi proteice, implicate impreuna in legarea protonilor.
Gruparea de glutamat se pare ca are rol decisiv in activarea mecanismului prin care protonii sunt folosiți pentru indepartarea medicamentelor cationic- hidrofobe.
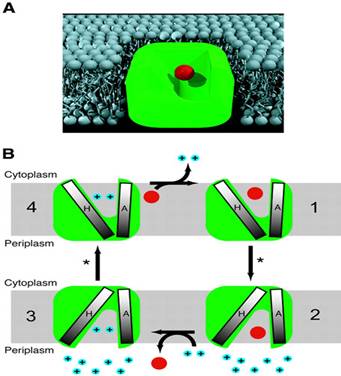
Fig.20. Mecanism de transport al EmrE. A.
analiza structurala a legarii TPP+ la substratul lipidic.
B. Schimbari structurale conformaționale in timpul efluxului.
http://www.nature.com/emboj/journal/v22/n23/fig_tab/7595521f6.html
Forma in X a aranjamentului din α1s, și poziția restului glutaminic, realizeaza consistența punctului pivot, studii ce au aratat ca Glu -14 este singurul rest din α1 ce poate fi legat la HgCl2 la inlocuirea cu cisteina, arata calea de translocație a medicamentelor, interfața dovedita in urma studiilor biochimice.