
|
|
|
Calculul entropiei conventionale
Principiul al treilea permite astfel calculul entropiei unei substante la temperatura T, din date calorimetrice, prin ecuatia cunoscuta:
![]()
sau la presiune constanta:
![]()
Prin integrare, pentru o serie de transformari de faza ale substantei intre 0 K si temperatura T (transformari polimorfe, topire, vaporizare), se obtine ecuatia generala a entropiei la temperatura T:
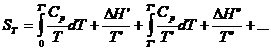 (XV.6)
(XV.6)
Capacitatile calorice la presiune constanta si
caldurile de transformare sunt masurabile pana la 10 K. Entropia
unui cristal la temperatura T (intre
10 si 20 K) este data de relatia 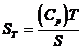 , conform legii lui Debye, care arata ca in
apropierea lui zero absolut Cp = Cv = aT3,
unde a este o constanta.
, conform legii lui Debye, care arata ca in
apropierea lui zero absolut Cp = Cv = aT3,
unde a este o constanta.
Astfel, primul termen din ecuatia (XV.6) devine:
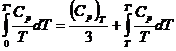
Integralele din ecuatia (XV.6) se obtin grafic din diagrame ![]() sau Cp - lnT.
Pentru calculul entropiei unui gaz in starea standard (S0), gaz perfect la 1 atm, se utilizeaza
corectia de gaz perfect dedusa din ecuatia lui Berthelot (v.
problema XVI.15):
sau Cp - lnT.
Pentru calculul entropiei unui gaz in starea standard (S0), gaz perfect la 1 atm, se utilizeaza
corectia de gaz perfect dedusa din ecuatia lui Berthelot (v.
problema XVI.15):
![]()
Valoarea acestei corectii este de ordinul 0,1 u.e.
Valoarea entropiei se poate determina si din date spectroscopice.
Exemplul 4 Sa se arate ca, aplicand
ecuatia capacitatii calorice a lui Debye, entropia unui cristal
perfect la temperatura foarte scazuta T (10-20 K) este egala cu ![]() .
.
Rezolvare:
Deoarece in apropiere de 0 K, CP = CV = aT3, ecuatia:
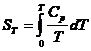
se poate scrie:
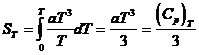
Exemplul 5 Curba din (fig. XV.2) reprezinta variatia cu temperatura a capacitatii calorice molare a oxalatului de calciu, intre 19,31 si 251 K.
Sa se determine entropia oxalatului de calciu la 251 K.
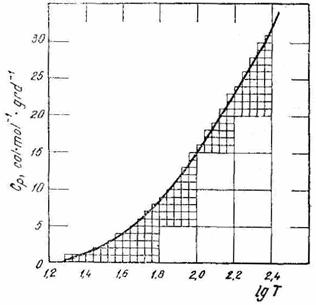
Fig. XV.2. Diagrama capacitatii calorice
molare a oxalatului de calciu
Rezolvare:
Variatia de entropie intre 19,31 si 251 K este data de expresia:
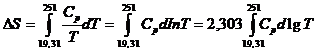
care se rezolva grafic. Numarul de patratele de sub curba, intre lg 19,31 (=1,286) si lg 251 (=2,400), este obtinut prin numarare directa: 340 patratele.
Deoarece fiecare patratel are ca latura verticala o unitate si ca latura orizontala 0,04 unitati, suprafata patratelului este 0,04 unitati:
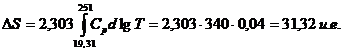
Deoarece entropia la 251 K este:

trebuie cunoscuta
valoarea primei integrale. Integrala 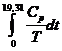 se poate evalua cu o
suficienta exactitate (±0,05 u.e.) prin legea lui Debye.
se poate evalua cu o
suficienta exactitate (±0,05 u.e.) prin legea lui Debye. 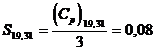 u.e. (v. exemplul
XV.4).
u.e. (v. exemplul
XV.4).
Prin urmare: S = 0,08 + 31,32 = 31,40 u.e.
Exemplul 6. La temperaturi joase fosfina are mai multe modificatii cristaline. Deasupra temperaturii 49,43 K este stabila forma α. Prin racire lenta, sub 49,43 K, se obtine forma β, iar prin racire rapida sub 30,29 K, forma γ (metastabila).
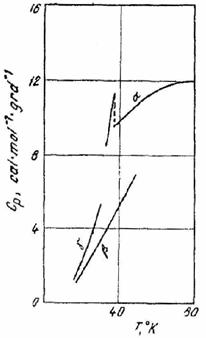
Fig. XV.3. Diagrama capacitatii
calorice molare a fosfinei
Pe baza datelor de mai jos si a diagramei capacitatii calorice din (fig. XV.3), sa se verifice principiul al treilea, calculand entropia α - fosfinei la 49,43 K.
Temperatura de tranzitie: ![]() 49,43 K
49,43 K
Caldura de tranzitie: ![]() 185,7 cal · mol-1
185,7 cal · mol-1
Temperatura de tranzitie:![]() 30,29 K
30,29 K
Caldura de tranzitie: ![]() 19,6 cal · mol-1
19,6 cal · mol-1
Rezolvare:
Tabela entropiei α - fosfinei, la
49,43 K, prin cele doua metode: transformarea ![]() si transformarea
si transformarea ![]() .
.
In primul caz, ![]() :
:
Temperatura S
0-15 K (extrapolare) 0,338
15-49,43 K (grafic) 4,041
49,43 K![]() 3,757
3,757
S49,43 K; α - fosfina 8,14 u.e.
In al doilea caz, ![]() :
:
Temperatura S
0-15 K (extrapolare) 0,495
15-30,29 K (grafic) 2,185
30,29 K![]() 0,647
0,647
30,29-49,43 K (grafic) 800
S49,43 K; α - fosfina 8,13 u.e.
Rezultatul obtinut arata ca cele doua forme β si γ au aceeasi entropie la 0 K.
Sa se stabileasca daca utilizarea formei γ metastabila este in contradictie cu enuntarea principiului al treilea in ultima forma ( §2).
Exemplul 7. O metoda de verificare a principiului al treilea consta in compararea valorilor variatiei de entropie a unei reactii chimice, calculate din valorile entropiilor individuale si din datele de echilibru (de exemplu, constanta de echilibru si forta electromotoare a pilelor).
Sa se verifice principiul al treilea in cazul sistemului Ag(s), Cl2(g), AgCl(s), cunoscand ca f.e.m. standard a pilei:
![]()
in care are loc
reactia ![]() este 1,136 V la
298,16 K.
este 1,136 V la
298,16 K.
Rezolvare:
Conform ecuatiei cunoscute![]() , se obtine:
, se obtine:
![]()
si pentru 298,16 K rezulta:
![]()
In tabelele termochimice se gaseste ![]() . Prin urmare:
. Prin urmare:
![]()
Mai exact, cunoscand coeficientul de temperatura al f.e.m:
![]()
se obtine, conform ecuatiei (XIV.31):
![]()
Pe baza valorilor entropiilor individuale (din tabele) se calculeaza:
![]()
(valoarea
exacta este![]() ).
).
Concordanta este, deci, foarte buna.
1. Sa se calculeze entropia n-heptanului lichid la 298,1 K, cunoscand valorile capacitatii calorice molare la presiune constanta, la diferite temperaturi:
T, K
Cp, cal · mol-1 · grd-1
T, K
Cp, cal · mol-1 · grd-1
15,14
17,52
19,74
21,80
24,00
26,68
30,44
34,34
38,43
42,96
47,87
53,18
65,25
71,86
1,500
2,110
2,730
3,403
4,122
4,935
6,078
7,370
8,731
10,02
11,02
12,80
15,69
17,04
79,18
86,56
96,20
106,25
118,55
134,28
151,11
167,38
194,60
218,73
243,73
268,40
296,51
18,53
19,83
21,58
23,22
25,09
27,15
29,54
31,96
48,07
48,49
49,77
51,71
53,68
La temperatura de topire (182,5 K) entalpia de topire este 3356 cal · mol-1.
2. Prin legea lui Debye si integrare grafica, entropia
hidrazinei in stare solida la temperatura de topire (+1,53 oC)
este 16,05 u.e. Caldura de topire la +1,53 oC este ![]() .
.
Capacitatea calorica a hidrazinei in stare lichida, intre 1,53 si 25 oC, este Cp = 23,37 + 0,014(T - 280) cal · mol-1 · grad-1.
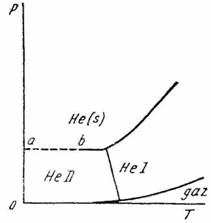
Fig. XV.4. Diagrama de echilibru a heliului
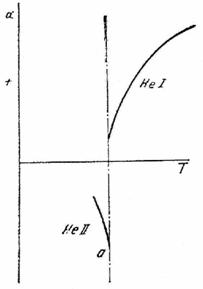
Fig.XV.5. Diagrama coeficientului
de dilatatie a heliului (l)
Caldura de vaporizare la +25 oC este ![]() .
.
Presiunea de vapori este data de ecuatia:
![]()
Sa se calculeze entropia hidrazinei la 1 atm si 25 oC, in stare de gaz perfect.
3. Diagrama de echilibru a heliului este de forma indicata in (fig. XV.4).
Sa se arate ca, in conformitate cu principiul al treilea, curba ab este perpendiculara pe axa ordonatelor.
4. Diagrama din (fig. XV.5) reprezinta variatia coeficientului de dilatatie α, cu temperatura, pentru He I si He II (in domeniul temperaturilor foarte scazute).
Sa se constitue trasarea curbei α catre T = 0 K si sa se justifice forma curbei.
5. Sa se discute metodele de verificare experimentala a principiului al treilea (v. exemplele XV.3, XV.6, XV.7 si problemele XV.10 si XV.11).
6. Sa se verifice relatia:
![]()
valabila pentru saruri binare, in care Vi este volumul molecular calculat din raze ionice.
7. Sa se verifice relatiile valabile pentru combinatii organice:
a) solide: S298 = 1,1 Cp (la 298 K);
b) lichide: S298 = 1,4 Cp (la 298 K).
8. Pe baza tabelelor de constante termodinamice sa se calculeze variatiile de entropie in reactiile de formare a hidratilor cristalini:
AmBn(s) + xH2O(s) =AmBnxH2O(s)
si sa se interpreteze rezultatul.
9. Sa se arate ca, pentru 0 K, se verifica ecuatia Cp - CV = 0.
10. Sa se calculeze entropia mercurului la 0 K, cunoscand urmatoarea compozitie izotopica:
![]()
![]()
196Hg
![]() 201Hg
201Hg
![]()
198Hg
![]() 202Hg
202Hg
![]()
199Hg
![]() 204Hg
204Hg
![]()
200Hg
![]()
Este posibila o valoare (pozitiva) mai mare sau mai mica decat valoarea calculata prin ecuatia cunoscuta a entropiei de amestec?
11. Se stie (cap. VIII) ca tensiunea superficiala scade cu temperatura dupa o curba analoaga ca forma cu cea din (fig. XV.6). Sa se arate ca, in domeniul temperaturilor mici, curba γ(T) devine perpendiculara pe axa ordonatelor.
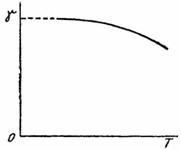
Fig. XV6. Variatia tensiunii
superficiale cu temperatura
12. Pe baza diagramei capacitatii calorice molare a acidului clorhidric (fig. XV.7) si a datelor de mai jos, sa se calculeze entropia acidului clorhidric (gaz perfect) la temperatura de fierbere. Valoarea calculata din date spectroscopice (v.vol. II) este 41,45. u.e.
a) Tranzitia HCl(s1) → HCl(s2)
temperatura 98,36 K
caldura de tranzitie 284,3 cal · mol-1
b) Topire HCl(s2) → HCl(l)
temperatura 158,91 K
caldura de topire 476 cal · mol-1
c) Vaporizare HCl(l) → HCl(g)
temperatura 188,07 K
caldura de vaporizare 3 860 cal · mol-1
13. Pe baza
principiului al treilea, la 298,16 K, pentru reactia Mg(OH)2(s)
= MgO(s) + H2O(g), se obtine din calcule o variatie de entropie
![]()
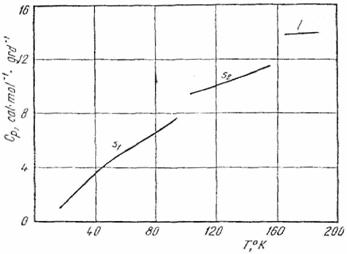
Fig. XV.7. Capacitatea calorica molara a Hcl
Valoarea determinata experimental din date de echilibru si
caldura de reactie este ![]()
Sa se explice diferenta intre cele doua valori.
*14. Sa se arate ca expresia caldurii specifice valabila la temperaturi joase:
c = aTb
b trebuie sa fie mai mare decat unitatea.
*15. Enuntarea principiului al treilea se face si sub forma:
este imposibil de a cobori temperatura unui sistem la 0 K printr-un
numar finit de operatii. Sa se arate ca acest enunt
rezulta din expresia: ![]() .
.