
|
|
|
STRUCTURA SI MECANISMUL DE TRANSPORT AL GLYCEROL-3-PHOSPHAT-ULUI (Esherichia coli) - GlpT
Superfamilia majora a facilitorilor reprezinta cel mai complex grup de transportori secundari ai membranei celulare. GlpT, prezentat in acest subcapitol, faciliteaza transportul glicerol - 3- fosfatului in citoplasma si a fosfatului anorganic in periplasma.
Jumatatile amino si carboxi-terminale ale proteinei emit o pseudo bisimetrie.
Cele 2 arginine prezente la nivelul porului central aflat in preajma periplasmei, comprima situsul de legare la substrat.
Se presupune ca GlpT opereaza cu un singur situs de legare, alternand mecanismul de acces printr-o rotatie de tip rocker-switch.
Transportul membranar in celula este un proces biologic fundamental mediat de diverse proteine de transport. Un tip foarte important de astfel de proteine sunt transportorii activi de membrana, ce folosesc un gradient solubil pentru conducerea translocatiei in alte substraturi.
Cei 1000 de membri ai suprafamiliei de transportori facilitanti, transporta ioni, zaharide, medicamente, neurotransmitatori, nucleotide, aminoacizi, peptide si alte solutii hidrofile.
Membrii acestei superfamilii sunt prezenti la nivelul celor 3 regnuri de organisme vii, si multi au relevanta medicala sau farmacologica.
La bacterii, aceste proteine functioneaza in principiu pentru preluarea nutrientilor, dar unele se comporta ca pompe de eflux ce confera rezistenta la antibiotice.
La E.coli, G3p serveste ca sursa
de energie si de carbon, si ca precursor al biosintezei de
fosfolipide. GlpT este un sistem antiport de fosfat organic/ fosfat anorganic
(Pi ), cu rol in preluarea de G3p, condus de gradientul Pi .
In sisteme reconstituite, acest transportor poate constitui mediator de schimb
Pi /Pi.
GlpT se leaga la substrat in solutii de solvent, iar in urma reconstituirii sub forma de proteolipozomi, mediaza G3P in schimbul de Pi .
Proteina este inrudita cu transportorul hexoza-6-fosfat (UhpT).
Structura analizata in urma cristalografierii cu raze X, la o rezolutie de 3.3 Ǻ, sugereaza un mecanism de translocatie la nivel de subtrat.
Transportorul este alcatuit din 12 α-helice transmembranare cu densitati ce amintesc de cele ale unor lanturi aromatice. Molecula de GlpT are forma unui templu Mayan, cu etaj si parter, ambele rectangulare. Poate fi divizat in 2 domenii asemanatoare astfel incat jumatatea cu capat N-terminal sa fie legata de cea cu capat C-terminal printr-o portiune pseudo bisimetrica perpendiculara pe un plan.
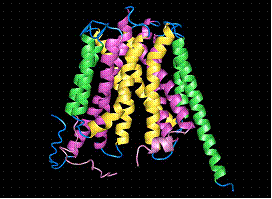
Fig.13. Structura 3D a moleculei de GlpT - transportoare de Glicerol- 3-Fosfat (G3P)/
O analiza de-a lungul membranei, arata aceasta portiune pseudo bisimetrica extinsa la nivelul tuturor helicelor, H1-H12, si la nivelul celor doua bucle (L1-L2, L11-L12), cu legarea H1-H7, H2-H8 si tot asa.
Interfata domeniului este aproximativ perpendiculara pe axa lunga a moleculei, unde se afla atat resturi proteice polare cat si apolare. Privind din interiorul suprafetei plane a membranei, de-a lungul intefatei domeniului, se poate observa un por inchis pe una din fetele membranei si unul deschis, pe cealalta fata.
In functie de lungimea helicelor este indusa pozitia portiunii pliate; H3, H6, H9, rezultand faptul ca periplasma este plata, dar coboara pe alocuri. In contrast cateva helice transmembranare se extind pe suprafata citoplasmatica a membranei.
In ambele jumatati ale moleculei, helicele formeaza 2 impachetari a cate 3 helice fiecare; H1-H5-H6 si H2-H3-H4 in domeniul cu capatul N-terminal, si H7-H11-H12 si H8-H9-H10 in domeniul capatului C-terminal.
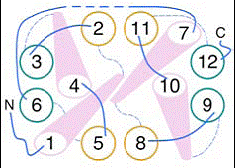
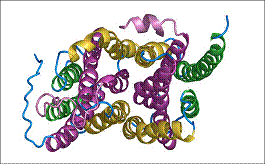
Fig.14 . Jumatati simetrice ale proteinei GlpT transportoare de G3P, model structural 3D
Aceste impachetari sunt inserate in membrana cu orientari opuse.
Fata de porul central, GlpT,emite 8 helice periferice ce formeaza un zid rectangular, cu functie de esafod pentru celelalte 4 helice centrale.
4 dintre helicele centrale, H3 si H6 N-terminale si H9 si H12 in C-terminal, formeaza peretii limitanti, ce contracta zidul, in timp ce peretii deschisi ai zidului ce limiteaza aceasta fortareata, sunt formati din helicele H2 si H11 in fata si H5 si H8 in spate.
Pentru ca ultimele 4 helice au forma curbata, in forma unei "banane", fiecare pereche capata forma incompleta, cu helicele intrand in contact in membrana dar fiind separate una de cealalta in citosol.
Pe partea citosolica a moleculei, cate 2 arginine, reprezentand semnatura proteinelor MFS, definesc cele 2 capete ale buclelor L2-3 si L8-9, bucla citoplasmatica 10-11 contine 2 lizine.
Se presupune ca aceste 2 resturi proteice cu sarcina electrostatica pozitiva, au rol in pozitionarea si orientarea helicelor transmembranare, la insertia proteinei in membrana, fapt observat la proteina Glut.
Mutatii intervenite la nivelul acestei proteine, prin schimbarea Arg de la capatul C-terminal cu o grupare triptofan, produce un sindrom deficitar de Glut.
GlpT purifica in solventi ca un monomer legat la substrat in solutie. Este omolog UhpT de la E.coli, unde s-a demonstrat ca nu doar purifica dar si functioneaza ca un monomer in membrana.
Este posibil ca si GlpT sa functioneze tot ca un monomer la nivel membranar, de aceea calea de translocație prin substrat in respectiva structura este porul central, aflat la interfata domeniilor N-terminal si C-terminal.
Deoarece porul se deschide doar la nivel citosolic, GlpT se afla in conformatie inchisa in absenta substratului. Pe partea cealalta a proteinei se afla o bariera, formata de H1 si H7, spatiul dintre ele fiind umplut cu 9 lanturi aromatice cu rol in inchiderea porului. Nu se mai formeaza cele 2 centuri aromatice de la suprafata membranei, spre deosebire de celelalte proteine reziduale.
Partea interna a porului masoara 10Ǻ cu 8Ǻ, are cateva lanturi laterale de aminoacizi ce patrund in por. Suprafata electrostatica este incarcata pozitiv, indeosebi in capatul cel mai intern.
Suprafata interna a "furnalului", este in mare parte hidrofoba, inafara de extremitatile din exterior, acest lucru sugerand faptul ca ionii si molecululele de apa nu adera la suprafata "furnalului".
Pentru ca legarea la substrat a moleculei GlpT este mediata de gruparea fosfat, are un comportament dibazic la pH fiziologic, legarea la substrat in ce priveste GlpT se presupune ca s-ar realiza datorita potentialului electrostatic pozitiv de suprafata.
Singura arie aflata in centrul porului cu aceasta insusire, se afla la capatul cel mai apropiat porului, in mijlocul membranei.
GlpT opereaza cu un singur situs de legare, pe modelul unui mecanism de acces alternativ.
Fig. 15. Miscarea de tip rocker- switch
specifica GlpT/ http://saturn.med.nyu.edu/research/sb/PSB06/Week2/SB-I-Transport-2006.pdf
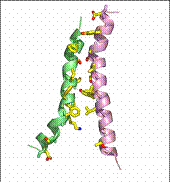
H8 H5 H2 H11
Pentru ca atomii de O ai legaturii fosfatidice a substratului sa formeze legaturi de H la lungimi optime (2.9 Ǻ) in acelasi timp cu gruparile guanidinice si argininice, aceste 2 tipuri de lanturi proteice trebuie sa se miste cam cu 1.4Ǻ mai aproape una de cealalta.
In concluzie, legarea la substrat se presupune ca avand rol de bariera energetica intre fetele interna si externa ale conformatiei proteinei transportoare GlpT, facilitand conversia si permitand gradientului de Pi sa conduca transportul de glicerol-3-fosfat.
Fig.16. Legarea la substrat, harta electrono-densa (2.9Ǻ)