
|
|
|
STRUCTURA ANTIPORTORULUI NhaA IN TRANSPORTUL Na+/ H+
Controlul in transportul de Na+/ H+ in pastrarea concentrației normale in ioni, precum și in pastrarea volumului celulei, este esențial pentru viabilitatea tuturor celulelor.
Adaptarea la o salinitate ridicata și/sau la un pH extrem la plante și bacterii sau in mușchii inimii la om, presupune activitatea antiportorului de Na+/H+, activitate strans coordonata de nivelul pH-ului.
 Principalul
antiportor al E.coli, precum și
a altor enterobacterii, este cristalul de NhaA, transportor cu rol de
echilibrare a concentrației pH-ului.
Principalul
antiportor al E.coli, precum și
a altor enterobacterii, este cristalul de NhaA, transportor cu rol de
echilibrare a concentrației pH-ului.
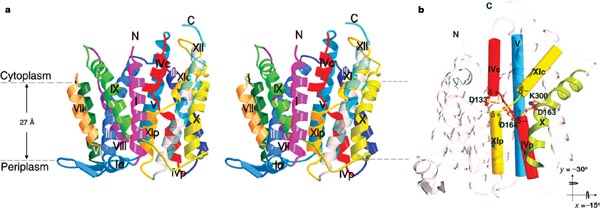
Fig.23. Arhitectura structurii 3D a cristalului de NhaA. /
Un "furnal" ionic, incarcat negativ, se deschide la nivelul citoplasmei și se termina la mijlocul membranei, la nivelul situsului de legare ionica.
Aici, un ansamblu unic de 2 perechi de helice scurte incrucișate, impreuna cu extinderile lor, creaza un mediu electrostatic stabilizant.
Legarea la situsurile substratului cu incarcatura, cauzeazi un dezechilibru electric, inducand mișcari, ce permit un mecanism de acces alternativ rapid. Aceasta mașinarie de schimb ionic este reglata de o schimbare conformaționala, indusa de un semnal de pH, inițiat la intrarea in "furnalul citoplasmatic".
NhaA folosește gradientul electrochimic de protoni pe care il menține pe toata lungimea membranei bacteriene, expulzand Na+ in schimbul unui flux de protoni, la nivel celular.
Cristalizat, in spațiu, NhaA, prezinta 2 monomeri ce alcatuiesc un dimer asimetric, aflați intr-o orientare non-fiziologica, opusa.
NhaA conține 388 de resturi de aminoacizi, cu capetele N-terminal și C-terminal, expuse in citoplasma. Modelul structural cuprinde de la 9 la 384 resturi aranjate in 12 segmente transmembranare, molecula avand o dimensiune de 40Ǻ cu 45Ǻ și cu o inalțime de 50Ǻ.
Complexul NhaA este format din 2 domenii; A și B. 2 pachete cuprinzand 3 TMs-uri (III, IV, V, si X, XI, XII) formeaza domeniul A, pachetele fiind inrudite structural.
Domeniul B este format dintr-o impachetare lineara a 6 helixuri (II, VII, VIII, IX, in centru, și I și VI atașate periferic pe laterale opuse.
Helicele TMs IV și XI sunt așezate in poziție opusa in membrana, notate "p" și "c" datorita inserției primei in periplasma, respectiv citoplasma, sunt orientate antiparalel cu partea N-terminala incarcata pozitiv, stand fața in fața la mijlocul membranei.
Cele 2 domenii se afla in coordonare deplina cu pachetele helicate observate in structura 3D a NhaA prin tehnica de microscopie crio-electronica a cristalelor in vedere 2D, obținute la randul lor la pH acid.
In centrul interfaței domeniului, se deschide un "furnal", format de helicele II și IX din domeniul B, din helixul Ivc și lanțul sau extins, și helixul V al domeniul A.
Potențialul electrostatic de suprafața, vazut dinspre citoplasma, este incarcat cu sarcini negative, restul membranei citoplasmatice este incarcat negativ, la fel și la nivel periplasmatic.
"Furnalele" citoplasmatic și periplasmatic sunt indreptate unul catre celalalt, dar nu formeaza un por continuu. "Furnalul" NhaA este inalt specializat in atragerea cationilor și in creșterea concentrației locale, fața de cea a anionilor.
1. MECANISMUL DE REGLARE AL pH-ULUI, PRIN SCHIMBUL DE DE Na+/H+
Principalul rol fiziologic al NhaA este menținerea echilibrului citoplasmatic al pH-ului, și a conținutului in Na+ (Li+).
Pentru menținerea unui pH intracelular constant, surplusul de Na+ (Li+), toxic pentru celula, este expulzat in schimbul cu protoni.
Activitatea sa alterneaza pe 3 nivele de magnitudine, intre pH7 și pH8, și este pe deplin reglat in scadere pana la un pH6.5.
Modelul general acceptat, explica schimbul de Na+/H+ și alte procese secundare de transport, este mecanismul de acces alternativ. Acest model presupune ca transportorul sa dețina 2 conformații alternative majore la nivelul situsurilor de legare la substrat, orientate fie inspre sau dinspre substratul respectiv.
Fig. 24. Pasajul substratului și
bariera periplasmica/ a. alinierea
pasajului periplasmic și citoplasmic, b. situs catalitic al
NhaA, c. vedere citoplasmatica de-a lungul membranei, d. secțiunea
incrucișata prin antiportor, e. vedere periplasmica de-a lungul
membranei. / http://www.nature.com/nature/journal/v435/n7046/fig_tab/nature03692_F3.html#figure-title
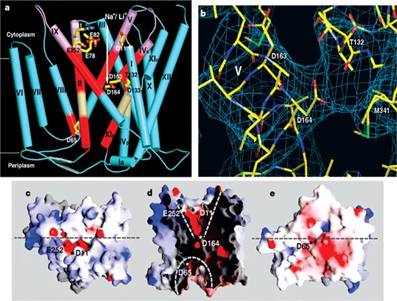
Interconversia celor 2 conformații intr-un antiportor este posibila doar printr-o legatura la substrat formata de o proteina.
Pentru NhaA, acest lucru inseamna ca legatura este susținuta fie de o grupare Na+/Li+, fie de 2 H+
Cele 2 grupari Asp ale situsului de legare sunt situate la nivelul helixului V, nu deține structuri specifice pentru eventualele schimbari conformaționale.
La pH acid, doar o parte a situsului de legare cationica este expusa caii de trecere a cationilor, in timp ce pasajul periplasmic este blocat de o bariera ionica formata parțial de helixul XIp, la pH alcalin, conformația helixului XIp și orientarea acestuia se schimba impreuna cu cea a helixului Vc.
Legarea propriu-zisa a Na+/Li+ la situsul activ, intervine in urma dezechilibrarii incarcaturii ce ar determina mișcarea helicelor XIp și Ivc, precum și a lanțurilor lor extinse.
Situsul de legare al cationilor este astfel expus periplasmic și separat și inchis in citoplasma. In eliberarea Na+/H+, ambele grupari de Asp devin protonate, determinand astfel o schimbare conformaționala, expunand și deschiderea citoplasmica, deprotonizarea inchizand ciclul.
Deși multe aspecte ale mecanismului de translocație ionica și de reglare a pH-ului, sunt dezvaluite de structura NhaA, determinari la rezoluții ridicate ale legaturilor Li+ sau Na+, fiind necesare in ințelegerea legarii proteinelor și a mecanismului de translocație la nivel atomic. Conformația indusa la pH alcalin, este esențiala in ințelegerea controlului pH-ului și a accesului de protoni la situsul de legare.
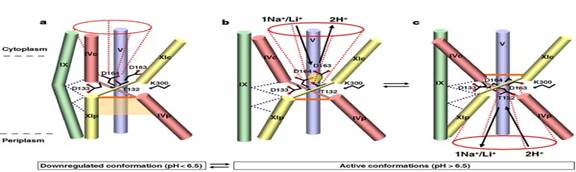
Fig.25. Mecanism de transport a reglarii pH-ului și translocația NhaA. A. conformația in mediu cu pH acid. B. Activarea schimbarii conformaționale indusa de pH-ul alcalin.C. Rezultatul legarii Na+(Li+) la deschiderea "furnalului"periplasmic. http://www.nature.com/nature/journal/v435/n7046/fig_tab/nature03692_F5.html#figure-title
2 STRUCTURA TRANSPORTORULUI DEPENDENT DE Na+/Cl- IMPLICAT IN TRANSPORTORUL DE NEUROTRANSMIȚATORI.
Transportorii dependenți de Na+/Cl-, mediaza transmiterea sinaptica folosind gradienții electrochimici in conducerea fluxului de neurotransmițatori, incluzand amine biogenice, de la sinapsa la citoplasma neuronilor și a celulelor gliale.
Acești transportori sunt țintele componentelor terapeutice, iar disfuncții la nivelul lor sunt implicate in boli ale sistemului nervos. Structura de cristal studiata la Aquifex aeolicus, arata un complex ce cuprinde și legarea la substrat a leucinei, și a 2 ioni de sodiu.
Miezul proteinei cuprinde un set de 10 din 12 segmente transmembranare, cu segmentele 1-5 legate cu 6-10 printr-o axa perpendiculara de simetrie in plan membranar.
Leucina și ionii de sodiu sunt legați la miezul proteic, la jumatatea distanței bistratului membranar, intr-o ocluzie datorata apei. Ca situs de legare al leucinei LeuTAa a proteolopozomilor stimulata de valinomicina, aceasta funcționeaza și ca ligand al celor 2 ioni de sodiu , numiți Na1 și Na2, legarea se face la nivelul regiunilor TM1 și TM6.
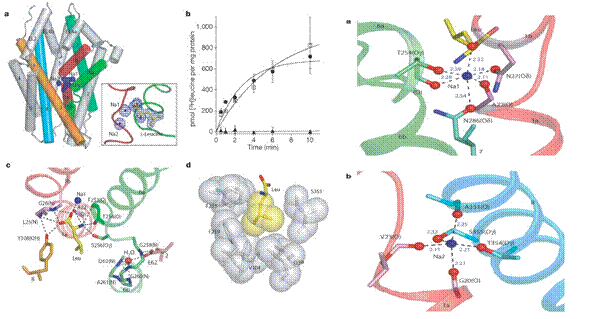
Fig.26. Situsuri de legare ale LeuTAa respectiv a ionilor de sodiu.
Situsurile de legare ale leucinei și a ionilor de sodiu sunt datorate decondensarii parțiale a helicelor transmembranare, cu atomi din lanțurile principale și cu dipoli helicați, indeplinind roluri cheie in legarea ionilor la substrat.
Comunicarea dintre neuroni, este esențiala pentru transmiterea impulsului nervos prin sinapse chimice, joncțiuni la nivelul carora semnalele electrice sunt eliberate de un neuron spre cel din imediata apropiere, pe calea clasica a neurotransmiterii mediatorilor de tip serotonina, norepinefrina, dopamina, glicina și GABA (acid γ-aminobutiric).
Sosirea unui potențial de acțiune la capatul terminal presinaptic, determina eliberarea acestor proteine mici, ce pot activa cu o rapiditate de milisecunde deschiderea canalelor ionice, sau pot avea o acțiune mai lenta data de receptorii cuplați ai proteinei G.
Dupa activarea receptorilor, acești neurotransmițatori sunt eliberați in sinapsa, inițial specific, prin inalta afinitate a transportorilor membranari, localizați la capatul terminal presinaptic, inconjurand mai apoi și celulele gliale.
Acest flux energetic are rol in reglajul electrochimic al concentrației ionice normale, dar și in inlocuirea depozitelor veziculare presinaptice de neurotransmițatori, printr-o clasa separata de purtatori veziculari.
Simportorii dependenți de Na+/ Cl-, folosesc gradientul electrochimic de sodiu și clor in cataliza supraincarcarii ce determina mișcarea termodinamica pe o arie larga a substratului, folosind și aminele biogenice (serotonina, dopamina, norepinefrina), aminoacizi (GABA, glicina, prolina, taurina) și produși ai osmozei (betaina, creatina).
Disfuncții la nivelul acestui simportor, sunt implicate in depresii, boala Parkinson, intoleranța ortostatica și epilepsie. De reținut ar fi faptul ca sunt ținta substanțelor ce creaza dependența: cocaina, amfetamina, precum și a unor agenți terapeutici de genul anticonvulsivi și a unor inhibitori de preluare selectiva a serotoninei.