
|
|
|
ACTIVITATEA INTRINSECA A RECEPTORILOR 5-HT
In sistemul nervos central, receptorii 5-hidroxitriptaminici 1A (5-HT1A), coexista in 2 populații diferite, cu efecte comportamentale și fiziologice diferite; 1) autoreceptorii somatodendritici localizați presinaptic in neuronul ce conține 5-HT și 2) receptorii localizați postsinaptic in neuroni ce conțin 5-HT.
Studii clinice au aratat ca agoniștii parțiali 5-HT1A, au proprietați anxiolitice, in timp ce antagoniștii autoreceptorilor presinaptici scurteaza timpul de preluare al inhibitorilor selectivi de serotonina (SSRIs).
In studiul activitații pre și postsinaptice al analogilor structurali de buspirona de la mamifere, a fost dezvaluit un model 3D al receptorului 5-HT1A, indicand similaritați in modalitațile de legare a intregii grupe de analogi ai buspironei.
Nu a fost demonstrata insa o relație intre resturile de contact ale receptorilor și receptorii pre și postsinaptici.
Comportamentul antagonistic presinaptic este dat de o deplasare larga a helixului TM7, in momentul legarii, pe cand comportamentul agonistic presinaptic, este datorat deplasarii largi a TM2 și o mica deplasare a TM7. In sistem analog, agonistul postsinaptic este conectat la deplasarea larga a TM4 și TM5, iar printr-o deplasare mai mica a acelorași helice, este corelata și activitatea antagoniștilor postsinaptici.
Proteina G cuplata la receptori (GPCRs), trimite semnalele de-a lungul membranei celulare, la acțiunea unui stimul -ligand pe fața externa, activand totodata o legatura heterotrimerica a proteinei G in interiorul celulei.
Analiza structurala a rhodopsinei de la bovine, cu ajutorul razelor X, este singura cunoscuta la o rezoluție de nivel atomic.
Caracteristicile structurale, funcționale și farmaceutice, au imparțit receptorii 5-HT in 7 familii mari (5-HT 1-7), cu una sau mai multe subdiviziuni. Exceptand 5-HT3, restul 5-HT sunt receptori de cuplare ai proteinei G (GPCRs).
Receptorii 5-HT1A, aparținand clasei de receptori cuplați Go/Gi, inhiba adenilatciclaza, crescand conductanța K+, și descresc activitatea de deschidere a canalelor de Ca2+, voltaj - dependente.
Atat receptorul 5-HT2A, cat și cel 5-HT2C, sunt implicați in reglajul anxietații, iar activitatea corelata a agoniștilor cu cea antagonista, ar avea o mai mare importanța in producerea efectelor anxiolitice, fața de buspirona.
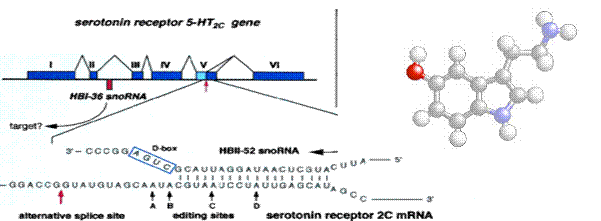
Fig.30. Structura unei gene de receptor al serotoninei, 5-HT2C /structura 3D
SSRIs, sunt folosiți in prima linie terapeutica in tratamentul antidepresiv. Activitatea lor antidepresiva, se presupune ca ar fi abolita de transmiterea prea rapida a 5-HT. O problema majora asociata SSRIs, o reprezinta acțiunea lor intarziata, datorita creșterii activitatii autoreceptorilor presinaptici 5-HT1A.
Dupa administrarea SSRIs, apare o desensibilizare a autoreceptorilor presinaptici 5-HT1A, și abia dupa 2-6 saptamani efectul antidepresiv devine vizibil.
Receptorii 5-HT se regasesc și la nivel intestinal. Neuronii intrinseci aferenti primari trebuie sa monitorizeze conditiile intraluminale prin intermediul epiteliului mucoasei. Acestia in mod evident indeplinesc acest rol folosind sistemul celulelor enteroendocrine ale mucoasei. Printre cele mai cunoscute celule ale acestui sistem sunt celulele enterocromafine care contin serotonina (5-hidoxitriptamina sau 5-HT). Aceste celule contin aproape 95% din serotonina din organism. Celulele enterocromafine elibereaza 5-HT ca raspuns la cresterea presiunii intraluminale sau la stimuli chimici, iar aceasta 5-HT joaca un rol important in initierea reflexelor secretorii și de peristaltica. S-a descoperit ca neuronii enterici exprima receptori pentru 5-HT de tipul 5-HT1A, 5-HT1P, 5-HT2A, 5-HT2B, 5-HT3, 5-HT4, din care doar 5-HT1P, 5-HT3 și 5-HT4 exercita actiuni excitatorii. Receptorii de tip 5-HT1A sunt cuplati cu proteine G, avand ca efecte inhibarea activitatii adenilatciclazei și deschiderea unor canale de K+. La nivel gastrointestinal, in plexul mienteric, au fost identificati receptori 5-HT1A cu rol de a modula in sens inhibitor potentialele postsinaptice excitatorii. Receptorii de tip 5-HT1P nu au fost identificati la nivelul sistemului nervos central ci doar la nivel intestinal. Acesti receptori initiaza o depolarizare de lunga durata in neuronii enterici, asociata cu o crestere a rezistivitatii membranare. Receptorii de tip 5-HT2A sunt cuplati cu proteina Gq, care stimuleaza fosfolipaza C cu producerea de inozitol trifosfat (determina cresterea concentratiei Ca2+ in citosol) și de diacilglicerol (activeaza proteinkinaza C). Acești receptori mediaza raspunsul contractil in diferite preparate de muschi neted, inclusiv mușchi neted ileal. Receptorii de tip 5-HT2B cuplati tot cu proteine de tip Gq, au fost descrisi initial la nivelul regiunii fundice a stomacului, activarea lor determinand contractia fibrelor musculare netede de la acest nivel. Au fost identificati ulterior și la nivelul intestinului subtire. Receptorii de tip 5-HT3 sunt receptori de tip canal ionic. Activarea acestora produce o depolarizare neuronala rapida, printr-un influx tranzitor, consecutiv deschiderii de canale cationice neselective. Acesti receptori pot fi desensibilizati și resensibilizati foarte rapid. Atat receptorii 5-HT3 de la nivelul tubului digestiv, cat și cei de la nivel central (localizati in area postrema și nucleul tractului solitar) sunt implicati in producerea vomei, mai ales cea produsa de chimioterapiile anticanceroase. http://www.emcb.ro). Receptorii de tip 5-HT4 sunt receptori cuplati cu proteine Gs, stimuland adenilatciclaza. Favorizeaza contractia fibrelor musculare netede intestinale cu cresterea peristaltismului și stimuleaza secretiile intestinale. Toti acesti receptori detin rol in motilitatea intestinala.
Activarea receptorilor 5-HT1A, conduce la o serie de efecte asupra fiziologiei și comportamentului. La șoareci, studiile experimetale, au aratat o creștere a nivelului de asimilare a nutrimentelor, o modulare de dependenta sexuala in comportament precum și hipotermie.
5. CONCLUZII
Transportul membranar realizat prin plasmalema, se datoreaza permeabilitații selective.
In funcție de consumul de energie dat de ATP, transportul se realizeaza pasiv (fara consum de energie) sau activ (cu consum de energie).
In funcție de marimea moleculelor transportate, transportul se imparte in transport de ioni (micromolecule) și al macromoleculelor, iar in funcție de numarul substanțelor transportate, poate fi uniport sau contraport (antiport sau simport).
TRANSPORTUL PASIV se realizeaza prin difuzie simpla prin bistratul lipidic.
In difuzia simpla mediata de peptide, transportul ionilor se realizeaza prin ionofori.
Difuzia facilitata se desfașoara de la o concentrație mai mare la una mai mica, substanțele transportate trec mult mai rapid decat ar fi de așteptat date fiind dimensiunea și solubilitatea lor in lipide.
Substanțele transportate de proteine specifice, se comporta ca enzime legate de membrana, avand caracteristice comune cu cataliza enzimatica.
Difuziunea simpla mediata de proteine-canal se deosebeste de difuziunea facilitata prin faptul ca viteza transportului poate fi mai mare decat in cazul difuziunii facilitate si transportul nu se satureaza, adica nu exista Vmax. Unele canale de transport sunt deschise in mod continuu, iar altele numai tranzitoriu. Acestea se numesc "canale de poarta". Unele canale se deschid la legarea unui ligand pe un receptor si le numim "canale cu poarta comandate de ligand". Alte canale dependente de potentialul membranei (voltaj) le numim canale cu poarta comandate de voltaj.
Mai exista si canale proteice care se deschid ca raspuns la cresterea concentratiei intracelulare a unor ioni: de exemplu canalele pentru K+ se deschid atunci cand creste concentratia Ca2+ in citosol.
TRANSPORTUL ACTIV este realizat de proteine transportoare cu o inalta specificitate si are si el caractere comune cu cataliza enzimatica: cinetica de tip Michaelis-Mentel. Ceea ce il deosebeste de difuziunea facilitata este consumul de energie. Transportul ionilor prin plasmalema si alte membrane se realizeaza de proteine care folosesc direct energia din ATP, aceste pompe ionice avand si proprietate ATP-azica. In transportul aminoacizilor si glucidelor prin plasmalema se foloseste energia gradientelor ionice (realizate prin ATP), deoarece transportul acestor substante se face cuplat cu transportul de Na+ (cotransport).
Transportul ionilor - pompa de Na+ si K+ din plasmalema si pompa de Ca2+ din plasmalema si din reticulul sarcoplasmic al celulelor musculare. Pompa de Na+ si K+ se afla in plasmalema tuturor celulelor animale si este responsabila de mentinerea potentialului membranar, dar si de controlul volumului si de "intretinerea" transportului activ al aminoacizilor si glucidelor.
Dupa 1957 s-a descoperit ca pompa de Na+
si K+ este aceeasi proteina cu Na+-K+-ATP-aza,
o enzima care scindeaza ATP-ul in ADP si fosfat anorganic (Pi) si
care necesita Na+ si K+ pentru activitatea
optima, fiind inhibata specific de glicozidele cardiotonice (digitala si
oubaina). Pompele de Ca2+ sunt
importante in mentinerea concentratiei scazute de Ca2+
in citosol(10-
Transportul activ cuplat cu gradiente ionice este reprezentat de transportul glucozei. Transportul glucozei prin plasmalema celulelor din mucoasa intestinala si a celulelor din tubii renali prezinta importanta foarte mare.
Transportul aminoacizilor se face tot prin sisteme simport cu Na+, ca și la glucoza, existand cel putin 5 proteine diferite in plasmalema celulelor animale.
Translocarea de grup se intalneste la unele bacterii si consta in fosforilarea unor glucide in cursul trecerii lor prin plasmalema.
TRANSPORTUL DIRECT AL UNOR MACROMOLECULE PRIN MEMBRANE
Exista cazuri speciale cand macromoleculele (ADN sau proteine) pot strabate direct membranele celulare fara a se forma vezicule. Asemenea situatii se intalnesc la bacterii in cursul procesului de transformare genetica, in care molecule de ADN trec atat prin peretele celular cat si prin plasmalema. In celulele eucariote proteinele de secretie trec direct prin membrana reticulului endoplasmic rugos pe masura ce sunt sintetizate. Unele toxine bacteriene trec prin plasmalema celulelor animale si isi exercita efectele in citosol. In cele mai multe cazuri macromoleculele sunt trecute prin membrane prin intermediul veziculelor
BIBLIOGRAFIE
1. Chang Geoffrey & Roth B. Christopher, Structure of MsbA from E.coli: A Homolog of a Multidrug Resistance ATP Binding Cassette (ABC) Transporters, Science, vol.293/2001
2. Chang Geoffrey, Structure of MsbA from Vibrio cholera: A Multidrug Resistance ABC Transporter Homolog in a Close Conformation, J.Mol.Biol, vol. 330, 419-430 / 2002
3. Davidson L. Amy, Not Just Another ABC Transporter, Science,vol. 296/2002
4.Dean Michael, Hamon Yannick & Chimini Giovanna , The human ATP - binding cassette (ABC) transporter superfamily, Journal of Lipid Research, vol. 42, 1007-1014/2001
5. Huang Yafei, Lemieux M. Joanne, Song Jinmei, Auer Manfred, Wang Da-Neng, Structure and Mechanism of the Glycerol-3-Phosphate Transporter from Escherichia coli, Science, vol. 301/2003, www.sciencemag.org
6. Hunte Carola, Screpanti Emanuela, Venturi Miro, Rimon Abraham, Padan Etana & Michel Hartmut, Structure of a Na+ /H+ antiporter and insights into mechanism of action and regulation by pH, Nature Publishing Group,vol.453/2005
7. Lunin V.Vladimir , Dobrovetsky Elena, Khutoreskaya Galina, Zhang Rongguang,, Joachimiak Andrzej, Doyle A. Declan, Bochkarev Alexey, Maguire E. Michael, Edwards M. Aled & Koth M.Christopher, Crystal structure of the CorA Mg2+ transporter, Nature Publishing Group,vol.440 /2006
8. Ma Che & Chang Geoffrey, Structure of the multidrug resistence efflux transporter EmrE from Escherichia coli,PNAS, vol. 101, no 9, 2852-2857,
www.pnsa.org/cgi/doi/10.1073/pnsa.0400137101
9. Nishida Motohiko & MacKinnon Roderick , Structural Basis of Inward Rectification: cytoplasmic Pore of the G Protein-Gated Inward Rectifier GIRK1 at 1.8Ǻ Resolution, Cell Press, vol.111/2002, 957-965
10. Strzelczyk Anna Agnieszka, Jarończyk, Chilmonczyk Zdzislaw, Mazurek Pawel Aleksander, Chojnacka - Wόjcik Ewa, Sylte Ingebrigt, Intrinsec activity and comparative molecular dynamics of buspirone analogues at the 5-HT1A receptors, Biochemical Pharmacology,vol.67/2004, 2219 - 2230
www.elsevier.com/locate/biochempharm
11.Yamashita Atsuko, Singh K. Satinder, Kawate Toshimitsu, Jin Yan & Gouaux Eric, Crystal structure of a bacterial homologue of Na+/Cl- -dependent neurotransmitter transporters, Nature Publishing Group, vol. 437/2005
12.Yernool Dinesh, Boudker Olga, Jin Yan & Gouaux Eric, Structure of a glutamate transporter homologue from Pyrococcus horikoshii , Nature Publishing Group, vol.431 /2004, www.nature.com/nature.
13. Yu W. Edward, McDermott Gerry, Zgurskaya I. Helen, Nikaido Hiroshi, Koshland Jr. E. Daniel, Structural Basis of Multiple Drug-Binding Capacity of the AcrB Multidrug Efflux Pump, Science, vol. 300/2003, 976-980