|
|
|
Sulf - Clor - Argon
F
Cl
Br
Tabelul intreg
Proprietati generale
Nume, Simbol, Numar atomic
Clor, Cl, 17
Serie chimica
Halogen
Grupa, Perioada, Bloc
VIIA (17), 3 , p
Densitate, Duritate
3.214 kg/m3
Infatisare
gaz verde-galbui
Fisier:Cl,11-thumb.jpg
Propietati atomice
Masa atomica
35,453 uam
Raza atomica (calc.)
100 (79) pm
Raza covalenta
99 pm
Raza van der Waals
175 pm
Configuratie electronica
[Ne]3s2p5
e- pe nivel de energie
2, 8, 7
Numar de oxidare (Oxid)
-1,0,1,3,5,7 (acid puternic)
Structura cristalina
Cristal ortorombic
Propietati fizice
Stare de agregare
gazoasa (nemagnetica)
Punct de topire
171,6 K
Punct de fierbere
239,11 K
Energie de vaporizare
10,2 kJ/mol
Energie de combinare
3,203 kJ/mol
Presiunea vaporilor
1,43 × 1300 Pa
Viteza sunetului
Nu exista rezultate
CLORUL ~Cl~
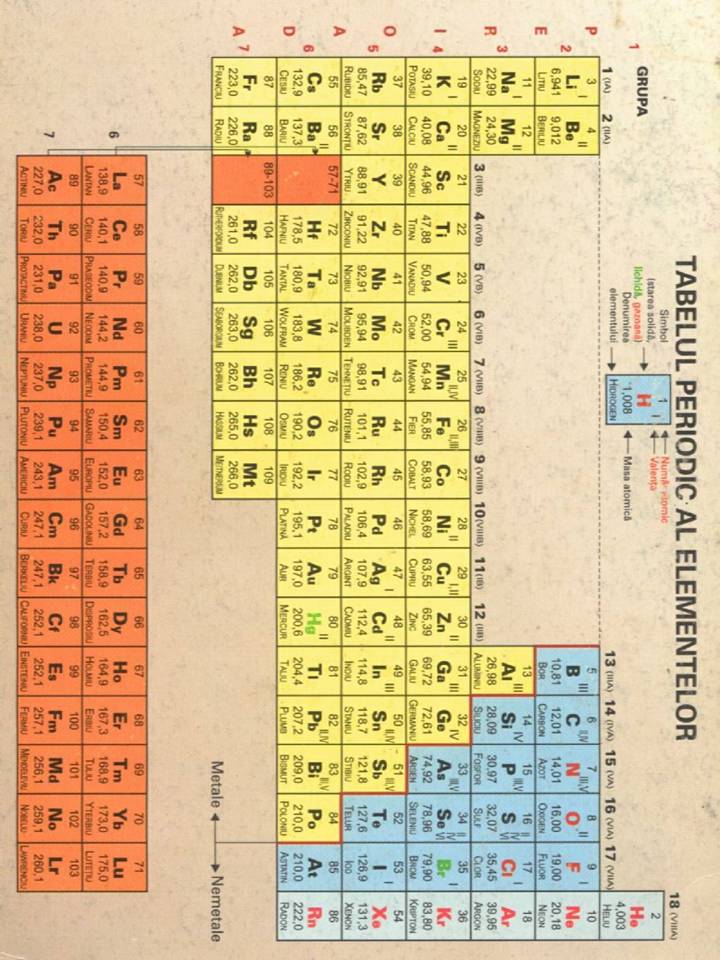
Clorul este atomul cu numarul de ordine 17, cu simbolul Cl. Se afla in grupa 17, sau VII principala(grupa halogenilor, si perioada a 3-a. Configuratia sa electronica este [Ne]3s23p5. Combinatia sa simpla cu sodiul, [NaCl] se regaseste in viata de zi cu zi, sub numele de sare de bucatarie. Molecula diatomica se prezinta, in conditii normale, sub forma de gaz verde-galbui , si este foarte toxica, fiind primul gaz de lupta folosit.
Clorul se gaseste in natura sub forma de cloruri. Clorurile alcatuiesc cea mai mare parte a sarurilor din apa oceanica - ionii clorura reprezinta aproximativ 1,9% din masa oceanica - dar se intalnesc si sub forma depozitelor solide in scoarta terestra.
In natura se gasesc doar izotopii 35 si 37, intr-o proportie de aproximativ 3:1, ceea ce da atomilor de clor o masa generala de 35,5.
Molecula diatomica de clor se poate obtine din clorurile sale prin oxidare cu agenti oxidanti puternici sau electroliza, sau din compusii cu numere de oxidare superioare lui 0 prin reducere.
Industrial, se obtine prin electroliza unei solutii de NaCl, dupa ecuatia:
2NaCl + 2 H2O → Cl2 + H2 + 2 NaOH] Stari de oxidare
Clorul poate avea urmatoarele stari de oxidare:
Clorul este folosit in purificarea apei, dezinfectanti, inalbitori fiind un gaz asfixiant este folosit si la producerea gazului de lupta gazul de mustar.
Clorul se regaseste si in utilizarile de zi cu zi:
In chimia organica se folosesc proprietatile oxidante ale clorului pentru a substitui atomi de hidrogen din componenta moleculelor, conferindu-le diferite proprietati superioare(de exemplu in copolimerii din cauciucurile sintetice)
Solutiile perfuzabile, denumite ser fiziologic sunt solutii de 0,9% NaCl.
Alte utilizari includ: producerea de clorati, cloroform, tetraclorura de carbon si extragerea bromului.