
|
|
|
![]() Aciditatea Lewis a
zeolitilor este pe de o parte datorata cationilor metalici (M+n)
care au abilitatea de a extrage o pereche de electroni de la o molecula de
reactant dupa ce in prealabil au fost calcinati la o temperatura
de peste 500 0C:
Aciditatea Lewis a
zeolitilor este pe de o parte datorata cationilor metalici (M+n)
care au abilitatea de a extrage o pereche de electroni de la o molecula de
reactant dupa ce in prealabil au fost calcinati la o temperatura
de peste 500 0C:
[M+2(Z![]() )2(H2O)n]-hidratat[M+2(Z
)2(H2O)n]-hidratat[M+2(Z![]() )2]-complet deshidratat
)2]-complet deshidratat
 fie prin conversia a
cate doua centre acide Brönsted prin eliminare de apa (dehidroxilare)
la cca. 500
fie prin conversia a
cate doua centre acide Brönsted prin eliminare de apa (dehidroxilare)
la cca. 500
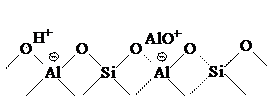
In acest fel apar 2
centre acide Lewis - un centru pe speciile de Al tricoordinat si unul pe
speciile +Sis si un centru Lewis bazic pe speciile Al![]() tetraedrice. In conditii normale, o parte din ionii Al
tetraedrice. In conditii normale, o parte din ionii Al![]() ies din retea in extraretea sub forma AlO+ si
compenseaza sarcinile negative ale ionilor Al
ies din retea in extraretea sub forma AlO+ si
compenseaza sarcinile negative ale ionilor Al![]() adiacenti. Se crede ca tocmai speciile extraretea AlO+
sunt centrele acide Lewis.
adiacenti. Se crede ca tocmai speciile extraretea AlO+
sunt centrele acide Lewis.
Prin adsorbtia
piridinei, spectroscopia IR distinge aciditatea Brönsted datorata ionului
piridiniu care vibreaza la 1545 cm![]() de cea Lewis datorata piridinei asociate care vibreaza la 1450 cm
de cea Lewis datorata piridinei asociate care vibreaza la 1450 cm![]()
Grupele OH
formeaza 2 benzi de absorbtie: una la cca. ![]() , caracteristica grupelor silanolice terminale sSi-OH si una in
regiunea 3600-
, caracteristica grupelor silanolice terminale sSi-OH si una in
regiunea 3600-![]() caracteristica aciditatii Brönsted data de grupele sSi-OH-Als
caracteristica aciditatii Brönsted data de grupele sSi-OH-Als