
|
|
|
In infarctul miocardic acut se realizeaza o reducere a circulatiei sanguine intr-o zona din tesutul miocardic datorita aterosclerozei arterelor coronare, o parte din tesut se necrozeaza, iar continutul celular din tesutul necrozat patrunde in circulatia sanguina, acest eveniment fiind reflectat prin intermediul parametrilor biochimici.
Primul indiciu al existentei infarctului miocardic acut este cresterea activitatii enzimatice plasmatice CK, acesta fiind urmat de cresteri ale activitatilor AST si LD. Activitatea LD ramane ridicata peste cinci zile de la declansarea infarctului miocardic, in schimb activitatile CK si AST raman ridicate (2 - 4) zile, foarte rar mai mult.
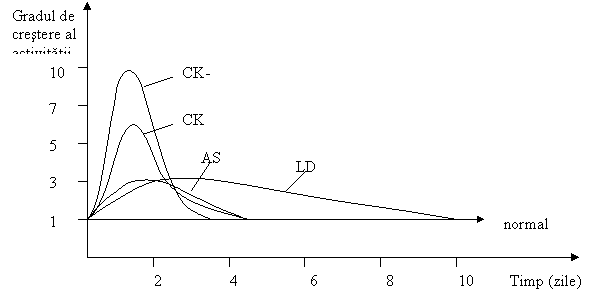
In infarctul miocardic cresterea
concentratiilor plasmatice CK, AST si LD prezinta o
dinamica ce este in concordanta
cu producerea obstructiei coronariene, patrunderea enzimelor
in lichidul interstitial si apoi in circulatia sanguina
(Fig. 8).
Miocardul contine aproximativ 80% CK-MM din totalul izoenzimelor CK si restul CK-MB, comparativ cu alte tesuturi musculare care contin aproximativ 3% CK-MB. Din aceasta cauza, in conditii normale activitatea enzimatica plasmatica este data de CK-MM, aportul celorlaltor enzime fiind neinsemnat.
Cresterea activitatii enzimatice plasmatice totale CK peste valoarea 160 U/l cuplata cu cresterea activitatii CK-MB la peste 5% din activitatea totala sunt sugestive in infarctul miocardic. Cresterile activitatilor enzimatice CK total si CK-MB sunt evidente in primele 24 ore dupa infarctul miocardic, activitatile enzimatice revenind le normal in urmatoarele 24 ore.
Spre deosebire de CK, activitatea enzimatica plasmatica a AST creste in mai mica masura in afectiunile musculare si in infarctul miocardic. Trebuie avut in vedere faptul ca se inregistreaza cresteri ale activitatii AST plasmatic in infarctul pulmonar si in afectiunile hepatice, fara ca activitatea CK sa creasca. Din aceasta cauza, in stabilirea diagnosticului este bine sa fie luat in calcul raportul CK/AST, care in afectiunile musculare scheletale are valoarea medie 27, iar in infarctul miocardic are valoarea medie 5.
Cresterile activitatilor enzimatice plasmatice LD in infarctul miocardic apar tardiv in comparatie cu CK si AST si din aceasta cauza aportul lor la stabilirea diagnosticului este neinsemnat. Daca investigatiile pentru determinarile activitatilor enzimatice plasmatice CK si AST nu sunt efectuate in primele zile de la declansarea infarctului miocardic atunci determinarile activitatilor LD pot avea valoare diagnostica, tinandu-se cont insa si de faptul ca apar cresteri ale activitatii acestor enzime si in anemiile megaloblastice.
Una din complicatiile infarctului miocardic este congestia hepatica, instalata rapid si care este acompaniata de cresteri ale activitatilor enzimatice palsmatice ale unor enzime de provenienta hepatica (ALT, AST, LD) care pot fi eronat interpretate ca fiind datorate infectiilor virale acute hepatice.
Staza hepatica este o alta complicatie a infarctului miocardic, care se materializeaza prin scaderea concentratiei colinesterazei serice si cresterea activitatii fosfatazei alcaline si γ-glutamil-transferazei (indicatori ai colestazei).
‼ Cresterea activitatii enzimatice CK total mai mult de opt ori decat valoarea normala si a AST mai mult de cinci ori decat valoarea normala este asociata cu infarctul extins, care creste riscul de mortalitate.
Valorile activitatilor totale ale CK si LD nu sunt totusi specifice infarctului miocardic acut, deoarece acestea cresc si in alte afectiuni cardiace sau necardiace.
Valorile diagnostice cele mai bune sunt cele care iau in calcul izoenzimele CK si LD si in special CK-MB, LD-1 si LD-2 (Tabel III)
Enzima
Inceputul cresterii (h)
Activitatea maxima (h)
Grad de crestere x U/l
Durata de crestere (zile)
CK
4 - 8
12 - 24
5 - 10
3 - 4
K-MB
4 - 8
24 - 38
5 - 15
2 - 3
AST
8 - 12
24
2 - 3
5
LD
12 - 24
72
2 - 3
10
LD-1 > LD-2
12 - 24
5
Pacientii care au suferit operatii pe cord (by-pass coronarian) pot avea niveluri ridicate ale activitatii CK-MB.
Cele mai importante enzime prezente in celulele musculare in concentratii mai mari sunt CK-MM, LD, AST si aldolaza.
Practic, in urma leziunilor musculare, ar trebui sa se inregistreze cresteri ale activitatilor plasmatice ale acestora. In realitate cresterea activitatii plasmatice este dependenta de activitatea musculara si fluxul sanguin de dupa lezarea musculara.
Dupa o interventie chirurgicala sau dupa contuzii, musculatura organismului se afla in repaos iar fluxul sanguin este diminuat (restrans) si din aceste cauze cresterile activitatilor CK-MM, AST si aldolaza sunt nesemnificative. In schimb dupa injectiile intramusculare cu diazepam, antiaritmice, tetracicline si peniciline se inregistreaza cresteri ale activitatilor plasmatice ale CK-MM.
In distrofiile musculare progresive, cand sunt diminuate manifestarile clinice locomotorii, activitatile enzimatice plasmatice CK, AST, LDH cresc si prezinta rol important in elaborarea diagnosticului precoce. Cu inaintarea distrofiilor materializate prin substituirea masei de tesut muscular cu tesut conjunctiv si grasimi, manifestarile clinice devin evidente, iar activitatile plasmatice se incadreaza in limite normale, datorita scaderii activitatii musculare sau a imobilizarii pacientilor
Distrofia musculara progresiva are caracter familial si prin dozarea activitatii enzimelor plasmatice pot fi evidentiati pacientii (barbati) predispusi la boala, a caror valori sunt peste limitele superioare normale.
Enzimele cu semnificatie clinica majora in diagnosticul bolilor hepatocelulare sunt: AST, ALT, LD si LD-5.
In genere in bolile inflamatorii hepatocelulare activitatea ALT este mai mare decat AST, iar in necroza celulelor hepatice activitatea AST indica cresteri mai mari.
In hepatita acuta se inregistreaza o scadere moderata a pseudocolinesterazei serice datorita alterarii functiilor biosintetice proteice ale ficatului. Cresterea activitatii pseudocolinesterazei serice in vederea revenirii in intervalul de normalitate indica un prognostic favorabil hepatocitar.
In hepatitele cronice se inregistreaza cresteri moderate ale transaminazelor, ca si in cirozele hepatice, datorita reducerii masei celulare. Diminuarea sintezei proteice hepatice in ciroza avansata conduce chiar la scaderea concentratiei ALT care se biosintetizeaza la acest nivel.
Tumorile hepatice nu sunt insotite de modificari esentiale ale activitatilor enzimatice, in schimb in metastaza hepatica se inregistreaza cresteri remarcabile ale LD si cresteri moderate ale transaminazelor.
In obstructia tractului biliar enzimele care au activitati ridicate sunt ALP si GGT. GGT este enzima cea mai sensibila pentru toate bolile hepatice, cu cresteri remarcabile in bolile obstructive.
In leziunile toxice ale ficatului (intoxicatii) se inregistreaza cresteri ale activitatii GGT si mai ales ale ALT, AST si LD.
Pentru cateva boli hepatice, mai frecvent intalnite, sunt prezentate in tabelul IV, activitatile enzimatice, ca rezultat al permeabilitatii membranare si ca indicatori ai functiei hepatice si ai colestazei.
Afectiune hepatica
Indicatori ai permeabilitatii membranare
Indicatori ai funtiei hepatice
Indicatori ai colestazei
Hepatita acuta
AST
ALT
PchE
ALP
GGT
Hepatita cronica
AST
ALT
PchE
ALP
GGT
Ciroza hepatica
AST
ALT
PchE
ALP
GGT
Colestaza
AST
ALT
PchE
ALP
GGT
Tumori hepatice
AST
ALT
PchE
ALP
GGT
Alcoolism cronic
AST
ALT
ALP
GGT
Intoxicatii acute
AST
ALT
LD
PchE
ALP
GGT
- crestere sau scadere slaba
- crestere sau scadere medie
- crestere sau scadere mare
- crestere sau scadere foarte mare
ALP este enzima a carei activitate creste remarcabil in afectiunile osoase, la care se adauga activitatea ACP.
In timpul cresterii copiilor, in jurul varstei de 10 ani, activitatea ALP este de patru ori mai mare decat la adult, maximul de activitate este la fete la varsta de 11 -12 ani si la baieti 13 -14 ani. Activitatea ACP este asociata cu activitatea osteoblastica.
Boala Paget este o boala cronica a scheletului in care se realizeaza o resorbtie excesiva a osului datorita activitatii osteoclastice. Resorbtia este urmata de faza osteoblastica in care depunerile sunt neuniforme. Din cauza stimularii osteoblastilor activitatea ACP poate depasi de 10 -100 ori activitatea normala.
In deficienta de vitamina D se instaleaza la copii rahitismul, iar la adult osteomalacia. Daca in rahitism se inregistreaza deficiente de crestere ale osului, in osteomalacie se dezvolta deficiente de calcifiere ale osului. In ambele cazuri se inregistreaza cresteri ale activitatii osteoblastice si cu aceasta si cresteri ale activitatii serice ALP.
Sarcomul osteogenic este unul din cele mai frecvente tumori de os, specifice varstei de 10 - 20 de ani, care evolueaza cu cresteri ale activitatii ALP, spre deosebire de mielomul multiplu unde activitatea ALP nu este marita.
Resorbtiile osoase excesive si metastazele osoase sunt acompaniate de regula de cresteri ale activitatilor ACP si ALP.
In diagnosticul proceselor maligne, fosfataza acida este cea mai uzitata, scaderea nivelului acesteia inregistrandu-se in cursul terapiei.
In metastaza osoasa creste activitatea ALP si ACP, ca si in metastazele hepatice unde se inregistreaza si cresteri ale LD si glutamatdehidrogenazei.
Carcinoamele de ficat, pancreas, bila sunt asociate cu cresteri ale ALP.
Leucemiile si limfoamele sunt asociate cu cresteri ale activitatii LD, ca si leucemia mieloblastica, leucemia limfoblastica acuta, leucemia limfatica cronica, limfomul Hodgkin. Cresterea cea mai spectaculoasa in aceste afectiuni se inregistreaza pentru LD-3.
Raportul LD-5/LD-1 > 1 s-a observat in tumorile primare de colon.
Carcinomul de plamani si prostata este asociat cu cresterea activitatii CK-BB.
Cresterea activitatii ACP in carcinomul de prostata nu este total specifica acestei afectiuni, deoarece cresteri ale activitatii se mai intalnesc si in hiperplazia nodulara, adenocarcinomul de plaman, pancreas, colon.
Masurarea ACP din coloana vertebrala se utilizeaza ca un indicator al carcinomului de prostata metastazat la nivelul coloanei vertebrale. Cresteri ale activitatii CK-BB s-au inregistrat in carcinomul de prostata (80% dintre pacientii care sunt in stadiul D al bolii). Tot in metastaza osoasa datorata carcinomului de prostata s-au intalnit cresteri ale activitatii ALP.
6. ENZIME IN PANCREATITA ACUTA
In pancreatita acuta pacientii prezinta dureri abdominale severe si enzimele proteolitice si lipolitice inactive pancreatice (fosfolipaza si tripsinogenul) devin inactive si initiaza autodistrugerea tesutului pancreatic si a vaselor de sange.
Se inregistreaza astfel edemul pancreatic cu o mortalitate de (5 - 10)% si respectiv necroza pancreatica hemoragica cu o mortalitate de (50 - 80)%.
Necroza este determinata de tripsina si fosfolipaza A2 active, iar hemoragiile sunt produse de elastaza activa care distruge tesuturile elastice vasculare. Enzimele pancreatice patrund in circulatia sanguina determinand vasodilatatia si cresterea permeabilitatii capilare, pana la soc.
Pancreatita acuta se asociaza cu alcoolismul si bolile tractului biliar. Nivelul amilazei incepe sa fie crescut la 2 -12 ore de la atac, se atinge maximul amilazemiei la 24 ore si amilazemia revine la normal in 3 - 5 zile. Valorile amilazemiei mai mari de 2,5 ori decat valoarea maxima a intervalului de normalitate sugereaza existenta pancreatitei acute.
Alte cauze ale durerilor abdominale (apendicita acuta, obstructia intestinala) prezinta valori ale amilazemiei mai mici decat de 2,5 ori valoarea maxima a intervalului de normalitate.
Datorita dimensiunilor mici ale moleculei de amilaza, in pancreatita acuta este evidentiata prezenta enzimei in urina. Nivelul amilazuriei este mare si ramane mare 7 - 10 zile dupa debutul pancreatitei acute.
Raportul clearence-ului amilaza / creatinina este luat in discutie ca un parametru nespecific pancreatitei acute. Clearence-ul amilazei este mai mare decat al creatininei datorita reabsorbtiilor greoaie ale enzimei. In conditii normale raportul este (2 - 5)%, in pancreatita acuta este (7 - 15)%. Cresteri ale raportului se inregistreaza si in cetoacidoza diabetica, in arderile extensive, perforatia duodenala, acestea contribuind la scaderea specificitatii raportului in diagnosticul de pancreatita acuta.
Activitatea lipazei in pancreatita acuta este aproximativ paralela cu cea a amilazemiei, cu un maxim la 24 ore, dar cu mentinerea activitatii mari, timp mai indelungat decat cea a amilazei.
Daca nici una dintre enzime (LPS si AMS) nu prezinta niveluri ridicate serice atunci este exclus diagnosticul de pancreatita acuta.
In pancreatita acuta, lichidul pleural prezinta un nivel ridicat al activitatii amilazei, cresteri inregistrandu-se si in carcinomul pulmonar sau metastatic.
In anemiile megaloblastice se inregistreaza cresteri ale activitatii plasmatice LD si in special LD-1 si LD-2 de pana la 40 de ori limita superioara a intervalului de normalitate. Dupa tratamentul cu vitamina B12 activitatea revine la normal dupa 2 - 3 saptamani (Fig. 9)
In anemiile hemolitice se inregistreaza cresteri ale activitatii plasmatice LD-1 si LD-2 mai putin pronuntata decat in anemiile megaloblastice. In anemiile hemolitice cronice nivelul LD este normal sau foarte putin crescut.
In alte anemii: feriprive, aplastice, posthemoragice nu apar cresteri ale LD sau ale altor enzime serice.
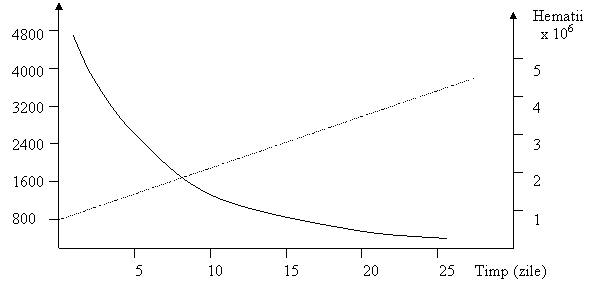
Fig. 9 Scaderea activitatii
plasmatice a LD in anemia megaloblastica (―) dupa tratamentul
cu vitamina B12, cuplata cu cresterea numarului de
hematii (---)
8. ENZIME URINARE
Urina este lichidul de excretie format la nivelul rinichiului prin filtrare glomerulara, reabsorbtie si secretie tubulara. In conditii normale, in urina se intalnesc enzimele cu mase moleculare mici: amilaza cu cele doua izoenzime salivara si pancreatica, lizozimul cu masa moleculara 11.000 - 15.000 D.
In urma leziunilor renale pot sa apara in urina si enzime cu masa moleculara mare: LD, AST, ALT, aldolaza, ALP, ACP, peptidaze.
Metodele de analiza pentru evidentierea urinara a acestora sunt de cele mai multe ori aceleasi cu cele aplicate pentru determinarea sanguina, cu observatia ca trebuie corectata ori de cate ori este necesar valoarea pH-ului acid urinar, pentru incadrarea in intervalul optim de activitate enzimatica specifica.
Deoarece eliminarile urinare de enzime nu sunt constante de-a lungul unei zile, determinarile se efectueaza pe urina colectata in 24 ore.
Pentru o exprimare mai corecta a proceselor de reabsorbtie si filtrare renale se utilizeaza clearence-ul, care reprezinta volumul (ml) de plasma epurati de o anumita substanta, in unitatea de timp. Clearence-ul pentru o enzima data se calculeaza prin produsul dintre concentratia urinara a enzimei si volumul urinar dintr-un minut, raportat la concentratia plasmatica a enzimei.
Izoenzimele salivara si pancreatica ale amilazelor se determina cel mai frecvent din urina prin migrare electroforetica.
Fata de valorile normale ale amilazuriei cuprinse intre 2 - 10 U/24 ore pot sa apara cresteri ale activitatii in pancreatita acuta si scaderi ale activitatii enzimatice in cancerul de pancreas si nefrite. Variatii ale activitatilor enzimatice ale AST si PAL se inregistreaza in sindromul nefrotic, iar ale AST si LD-3 in diverse tumori.
9. ENZIME IN LICHIDUL CEFALORAHIDIAN
Lichidul cefalorahidian (LCR) prezent in spatiul subarahnoidian are rolul de a proteja creierul si maduva spinarii impreuna cu meningele si de a servi ca mediu de schimb metabolic. Spatiul subarahnoidian are grosimi diferite cuprinse intre 1 - 10 mm, iar la nivelul celei de-a doua vertebre lombare are prevazut un sinus mai dilatat la nivelul caruia se realizeaza punctiile rahidiene.
LCR nu este doar un ultrafiltrat de plasma sau doar un dializat plasmatic, ci si un produs de secretie al sistemului nervos central (SNC). LCR este separat de plasma sanguina printr-o membrana care permite difuzia doar a apei si nu permite patrunderea substantelor macromoleculare din plasma.
In LCR exista un numar mare de enzime, care de regula prezinta activitate mai mare decat cele similare din plasma si de asemenea s-a constatat ca nu exista un paralelism intre activitatea enzimelor din cele doua lichide biologice.
Enzimele cu activitate mare in LCR sunt: AST, ALT, LD si in special LD-2, colinesterazele. In conditii normale CK lipseste din LCR si din aceasta cauza aparitia ei in acest lichid biologic presupune existenta unei leziuni a SNC.
Prezenta CK intr-un LCR limpede sau sanguinolent este cuplata cu existenta unei distrugeri de substanta nervoasa (interventie chirurgicala, traumatism, tumora). Gradul de distrugere al substantei nervoase este cu atat mai pronuntat cu cat activitatea CK estte mai mare in LCR.
LD este un marker nespecific al tumorilor, activitatea enzimei crescand la nivelul LCR si in infectiile bacteriene.
Datorita mutatiilor genetice, oricare din cele 2000 enzime identificate in organismele vii ar putea suferi modificari structurale care s-ar putea materializa prin modificarea activitatilor acestora, cu implicatii asupra metabolismului. In realitate, nu toate modificarile structurale rezultate in urma mutatiilor afecteaza activitatea enzimatica. Pentru manifestarea bolii datorate anomaliilor produse prin mutatii, este necesar ca subiectii sa mosteneasca gena patologica de la ambii parinti (homozigoti). De regula in organismele heterozigotilor (in care s-a mostenit o gena normala de la unul dintre parinti) anomalia nu se instaleaza, chiar daca activitatea enzimei respective este putin diminuata.
Consecintele mutatiilor asupra activitatilor enzimatice se materializeaza in:
sinteza unei proteinenzime cu activitate redusa atunci cand se substituie la nivelul centrului activ enzimatic, un rest de aminoacid cu altul. In acest caz activitatea enzimatica poate fi chiar pierduta.
sinteza unei proteinenzime cu structura modificata la nivelul centrului alosteric, care face ca enzima sa nu mai poata fi reglata prin intermediul efectorilor alosterici.
sinteza unei proteinenzime a carei modificari structurale apar in afara centrilor activi si alosterici, a carei activitate enzimatica se pastreaza, dar stabilitatea poate fi redusa in vivo, activitatea enzimatica scurtandu-se in timp.
proteinenzima nu se mai biosintetizeaza.
Deficitul enzimatic instalat in mutatiile genetice (alterarile codului genetic) poate avea mai multe consecinte:
acumularea substratului
deficit (lipsa) de produs de reactie
devierea cailor metabolice cu formarea altor produsi de reactie.
BIBLIOGRAFIE
1. R.H.Abelles, P.A.Fray, W.P.Jenks, Biochemistry, Jones and Bartlett Publishers, London, 1992
2. L.Adolph, R.Lorenz, Enzyme Diagnosis in Diseases of the Heart, Lung, Liver and Pancreas, S.Karger Ed., Basel, 1982
3. B.Alberts, D.Bray, J.Lewis, M.Raff, K.Roberts, J.D.Warson, The Cell, Garland Publishing Inc., New York, 1994
4. P.J.Andersen, H.Kaplan, Biochem.J., 137, 181 (1974)
5. C.Audigie, F.Zonszain, Biochimie Metabolique, Doin Ed., Paris, 1995
6. D.J.Bauhs, Biochemical Educational, 27(3),131 (1999)
7. M.L.Bishop, J.L.Duben, E.P.Fody, Clinical Chemistry, J.B.Lippincott Company, Philadelphya, 1992
8. S.Bon, F.Rieger, FEBS Letters, 53, 282 (1975)
9. H.Brockerhoff, R.G.Jensen, Lypolytic Enzymes, Academic Press, New York, 1974
1996