
|
|
|
Proteine Metaloproteine
Proteinele sunt substante organice macromoleculare formate din lanturi simple sau complexe de aminoacizi. In organism, exista 20 de aminoacizi din a caror combinatie rezulta o varietate infinita de proteine. Din cei 20 de aminoacizi cunoscuti, 8 sunt considerati esentiali, intrucat nu pot fi sintetizati in organismul omului si trebuie adusi zilnic cu alimentele. Acestia sunt valina, lizina, leucina, izoleucina, metionina, triptofanul, treonina, fenilalanina. Ceilalti au fost numiti neesentiali intrucat pot fi sintetizati in organism din alte substante.
Structura proteinelor
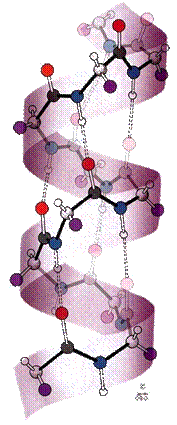 Complexitatea si diversitatea peptidelor si proteinelor se
datoreaza numarului mare de alternative de legare a unui numar
mic de a-aminoacizi in vederea formarii lor cat si unor
particularitati de conformatie si configuratie a
moleculelor acestora. Ele sunt generate de alternanta elementelor rigid
plane (legatura poliamidica conjugata) din structura cu elemente
de mobilitate (atomi de C hibridizati sp3) capabile sa genereze
chiralitate de axa (in final de spirala). In plus
posibilitatea stabilirii unor legaturi (van der Waals, de H, dipol-dipol,
inductie, dispersie inter si intramoleculare) conduc la stabilizarea
unor conformatii ca entitati bine individualizate. Sub denumirea
de structura primara este inclusa cunoasterea
felului aminoacizilor componenti ai unei peptide sau proteine si a
modului lor de legare. Atomii de C sunt hibridizati sp3.
Complexitatea si diversitatea peptidelor si proteinelor se
datoreaza numarului mare de alternative de legare a unui numar
mic de a-aminoacizi in vederea formarii lor cat si unor
particularitati de conformatie si configuratie a
moleculelor acestora. Ele sunt generate de alternanta elementelor rigid
plane (legatura poliamidica conjugata) din structura cu elemente
de mobilitate (atomi de C hibridizati sp3) capabile sa genereze
chiralitate de axa (in final de spirala). In plus
posibilitatea stabilirii unor legaturi (van der Waals, de H, dipol-dipol,
inductie, dispersie inter si intramoleculare) conduc la stabilizarea
unor conformatii ca entitati bine individualizate. Sub denumirea
de structura primara este inclusa cunoasterea
felului aminoacizilor componenti ai unei peptide sau proteine si a
modului lor de legare. Atomii de C sunt hibridizati sp3.
Determinarea structurii primare a proteinelor prezinta pe langa un interes stiintific si un interes medical direct. De exemplu absenta unui singur aminoacid (histidina) in hemoglobina poate fi responsabila de aparitia unei anemii puternice.
Clasificare
In functie de forma moleculelor, proteinele sunt de doua tipuri:
- Proteine fibrilare care au molecula filiforma si sunt, in general, insolubile in apa. Din aceasta grupa fac parte de exemplu fibroina, keratinele, colagenul etc.
- Proteine globulare a caror molecula are forma sferica sau elipsoidala si sunt usor solubile in apa. Din clasa proteinelor globulare fac parte toate enzimele, globulinele serice si alte.
In functie de rolul biologic principal pe care il indeplinesc, proteinele se impart in 6 clase astfel:
- Proteine structurale. Acestea sunt reprezentate de proteinele ce joaca rol plastic, adica acele proteine ce intra in structura membranelor biologice, a tesuturilor si organelor. Proteinele structurale cele mai bine studiate sunt: colagenul intalnit in tesutul conjunctiv din cartilaje, tendoane, piele, oase etc., elastina ce intra in structura tesutului conjunctiv elastic din ligamente, fibroina din matasea produsa de Bombix mori, sclerotina intalnita in exoscheletul insectelor, keratina ce se gaseste in cantitati mari in derma, par, pene etc., proteinele membranare ce intra in structura tuturor membranelor biologice si altele.
- Proteinele de rezerva au rolul principal de a constitui principala rezerva de aminoacizi a organismelor vii. Din aceasta grupa fac parte cazeina care este componenta proteica majora a laptelui, gliadina din cariopsele cerealelor, zeina ce reprezinta principala proteina de rezerva din boabele de porumb, ovalbumina si lactalbumina din oua si respectiv din lapte, feritina care faciliteaza acumularea ionilor de fier in splina si altele.
- Proteinele contractile au un rol important pentru miscarea organismelor vii fiind implicate in contractia muschilor, cililor, flagelilor etc. Cele mai bine studiate proteine contractile sunt actina si miozina implicate in contractia miofibrilelor si dineina care asigura miscarea cililor si flagelilor la nevertebrate.
- Proteinele de transport sunt proteine cu o structura deseori complexa ce indeplinesc un important rol in transportul diferitilor metaboliti in organism. Cele mai bine studiate proteine de transport sunt hemoglobina care asigura transportul oxigenului si dioxidului de carbon, mioglobina cu rol in transportul oxigenului la nivel muscular, albuminele serice care realizeaza transportul acizilor grasi in circulatia sanguina, lipoproteinele serice care asigura transportul lipidelor in sange etc. Tot din aceasta categorie fac parte si transportorii membranari care realizeaza transportul activ, contra gradientului de concentratie, al diferitilor metaboliti prin membranele biologice.
- Proteinele cu rol catalitic si hormonal reprezinta o grupa extrem de importanta de proteine functionale. Din aceasta grupa fac parte enzimele (care sunt toate, fara nici o exceptie, proteine), precum si unii hormoni (hormonii reglatori ai hipotalamusului, hormonii hipofizei, cei pancreatici, hormonii paratiroidieni, hormonii timusului etc.).
- Proteine cu rol de protectie. Acestea sunt proteine implicate in diferite procese fiziologice de protectie si aparare a organismului fata de anumiti factori externi. Cele mai bine studiate sunt trombina (o proteina ce participa la procesul coagularii sanguine), fibrinogenul (care este precursorul fibrinei, proteina implicata, de asemenea, in procesul coagularii sanguine), imunoglobulinele sau anticorpii (proteine capabile sa formeze complecsi anticorp - antigen cu proteinele straine organismului respectiv si altele.
In functie de structura lor chimica, proteinele se impart in doua mari grupe: proteine simple si proteine complexe.
- Proteine simple (holoproteine). Acestea sunt proteine ale caror molecule sunt formate numai din catene polipeptidice. Acest lucru a fost demonstrat prin faptul ca prin hidroliza completa, holoproteinele pun in libertate numai aminoacizi. Din aceasta grupa fac parte o serie de proteine ce indeplinesc importante functii biochimice si fiziologice α, β si γ-globulinele serice, anticorpii, histonele, protaminele, fibrinogenul, miozina, actina, colagenul, fibroina, keratinele etc.
- Proteinele complexe (numite si conjugate, sau heteroproteine) contin in molecula lor, pe langa componenta proteica si o componenta de alta natura numita grupare prostetica. La randul lor, heteroproteinele se impart in mai multe grupe in functie de natura chimica a gruparilor prostetice.
- Cromoproteinele contin in molecula lor o grupare prostetica de natura protoporfirinica. Din aceasta categorie fac parte o serie de proteine ce indeplinesc importante functii biochimice si fiziologice: hemoglobina, mioglobina, citocromii, catalaza, peroxidaza etc.
- Lipoproteinele contin in molecula lor grupari prostetice de natura lipidica. Din aceasta grupa fac parte, de exemplu, lipoproteinele serice.
- Fosfoproteinele. Gruparile prostetice ale hetero-proteinelor din aceasta grupa sunt reprezentate de resturi de serina esterificate cu acid fosforic. Cele mai cunoscute fosfoproteine sunt cazeina, vitelina, vitelenina, fosvitina si altele.
- Glicoproteinele contin grupari prostetice de natura glucidica (galactoza, manoza, unele hexozamine, acidul N-acetilneuraminic etc.). Din grupa glicoproteinelor sunt bine studiate γ-globulinele, orosomucoidul plasmatic, ovalbumina, glucoproteinele serice ce determina grupele sanguine si altele.
- Metaloproteinele contin unii ioni metalici (Fe2+, Fe3+, Cu2+, Zn2+) in calitate de grupare prostetica. Din aceasta grupa fac parte de exemplu alcooldehidrogenaza, enolaza, feritina, conalbumina, ceruloplasmina si altele. Trebuie mentionat faptul ca la metaloproteine, ionul metalic este legat direct de catenele polipeptidice ale componentei proteice si nu este inclus intr-o alta structura (cum ar fi nucleul protoporfirinic la cromoproteine).
- Flavoproteinele contin un flavinnucleotid in calitate de grupare prostetica. Din aceasta grupa fac parte flavoenzimele FMN- si FAD-dependente (succinat-dehidrogenaza, aminoacid-oxidazele etc.).
- Nucleoproteinele sunt poate cele mai importante proteine complexe datorita faptului ca gruparea lor prostetica este reprezentata de un acid nucleic. In functie de natura acidului nucleic ce joaca rol de grupare prostetica, ele se impart in ribonucleoproteine (nucleoproteine ce contin ARN) si deoxiribonucleo-proteine (ce contin ADN in calitate de grupare prostetica).
In moleculele proteinelor, resturile de aminoacizi sunt unite prin legaturi peptidice ca si in cazul peptidelor. Datorita efectelor electronice mentionate si in cazul proteinelor legatura peptidica prezinta un caracter partial de legatura dubla, impiedicand rotirea libera a substituentilor.
Numarul resturilor de aminoacizi ce intra in structura unei molecule proteice poate fi de ordinul sutelor, miilor si chiar zecilor de mii. Acestia pot forma una sau mai multe catene polipeptidice, in functie de structura, rolul biologic si mecanismele prin care proteinele respective isi exercita functiile biologice.
Metaloproteine
Hemina, complexul cu fier al porfirinei substituite in toate pozitiile pe inelele pirolice este materia colorata a hemoglobinei din sangele vertebratelor.
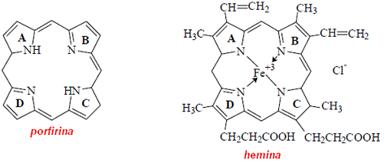
Hemina mai este prezenta si in unele nevertebrate, in muschi, in drojdie, in leguminoase etc. Deoarece ea se gaseste legata intotdeauna de proteine, este corect denumita hematoporfirina sau gruparea hem din mioglobina si hemoglobina.
Daca legatura 3,4 -C=C- din inelul pirolic D al porfirinei este hidrogenata, se obtine clorina. Ea formeaza baza clorofilei a si b, care sub forma de complex cu Mg2+ confera culoarea verde frunzelor.
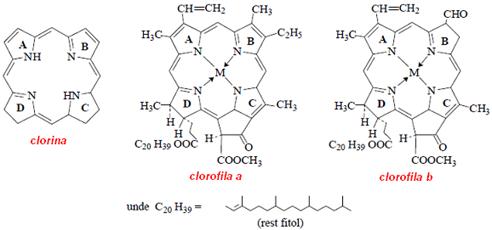
Daca legaturile -C=C- din inelele B si D sunt hidrogenate, rezulta structura de baza a bacterioclorofilei a si b.
Toti acesti coloranti naturali cu rol important pentru existenta omului, animalelor si plantelor fac parte din clasa [18]-aza-anulenelor. Ei sunt complecsi metalici, ionul metalic aflandu-se in centrul sistemului macrociclic, substituind atomii de H legati de atomii de azot in compusii nemetalici. Marea majoritate a porfirinelor sunt recomandate in calitate de aditivi alimentari si cosmetici.
Un compus in care mai multe duble legaturi sunt hidrogenate este asa numitul factor F430 din bacteriile metanogenice. Usor diferite, dar biogenetic inrudite cu porfirinele sunt carinele. Cel mai important reprezentant al acestui grup este vitamina B12, un complex cu cobalt. La fel ca si factorul F430, vitamina B12 nu include in structura un rest porfirinic, ambii compusi nefiind aza-anulene aromatice.
Rolul proteinelor
Proteinele au in principal un rol structural, adica sunt un fel de caramizi folosite la constructia celulei, a tesuturilor si a organelor. Proteinele sunt folosite si in sinteza anticorpilor si a enzimelor, transforma unele substante chimice toxice in substante netoxice, indeplinesc functia de transportatori formand diferite complexe (proteino-lipidic, proteino-glucidic, proteino-mineral, proteino-vitaminic, proteino-hidric si cu unele medicamente), participa la mentinerea echilibrului osmotic, intra in alcatuirea unor hormoni sintetizati, de exemplu in hipofiza sau in pancreas, au rol in transportul diferitelor minerale, vitamine sau al altor substante in sange.
Proteinele pot fi arse in organism cu scop energetic, 1 g de proteine eliberand 4 kcalorii.